十年技術(shù)深耕細(xì)作
為您提供各行業(yè)互聯(lián)網(wǎng)私人定制開(kāi)發(fā)解決方案
為您提供各行業(yè)互聯(lián)網(wǎng)私人定制開(kāi)發(fā)解決方案
科學(xué)家借助膠水首次實(shí)現(xiàn)造血干細(xì)胞體外千倍擴(kuò)增
幾十年來(lái),科學(xué)家都在追求能夠在體外大量擴(kuò)增造血干細(xì)胞(HSC)的辦法。
造血干細(xì)胞移植是血液腫瘤等血液病的終極解決方案,也與近幾年火熱的基因治療相關(guān)。但造血干細(xì)胞擴(kuò)增之難始終局限著臨床應(yīng)用。
如今這個(gè)問(wèn)題有了一個(gè)意想不到的解答。美日兩國(guó)科學(xué)家團(tuán)隊(duì)聯(lián)手發(fā)現(xiàn),阻礙造血干細(xì)胞擴(kuò)增的是培養(yǎng)基中存在的血清白蛋白,將其替換為一種高分子材料聚乙烯醇(PVA)即可令造血干細(xì)胞持續(xù)自我更新。在最優(yōu)培養(yǎng)條件下,小鼠造血干細(xì)胞在28天內(nèi)擴(kuò)增了近千倍!
該論文發(fā)表在近期的《自然》雜志上[1],通訊作者是斯坦福大學(xué)遺傳學(xué)教授中內(nèi)啟光(Hiromitsu Nakauchi)和東京大學(xué)干細(xì)胞生物學(xué)副教授山崎聰(Satoshi Yamazaki)。
多能自我更新造血干細(xì)胞移植后可以再生造血系統(tǒng),是免疫缺陷、白血病在內(nèi)多種疾病的治療方法,即我們常說(shuō)的骨髓移植。
但這種療法有個(gè)問(wèn)題。造血干細(xì)胞數(shù)量稀少,為了保證穩(wěn)定定植,需要對(duì)患者進(jìn)行放射或化學(xué)療法事先清除原有的造血干細(xì)胞,也就是俗稱的“清髓”。這一方面是為了給“新來(lái)的”供體細(xì)胞提供居住空間,一方面也是為了抑制免疫功能,避免它們誤殺外來(lái)者。
但清髓談何容易,免疫抑制、發(fā)育遲緩、不育、繼發(fā)性癌癥等副作用虎視眈眈,更別說(shuō)有些體質(zhì)較弱或年紀(jì)較大的患者根本無(wú)法耐受,自然也就沒(méi)法做骨髓移植。
長(zhǎng)時(shí)間里,科學(xué)家們一直在猜測(cè),是不是一次性移植大量的造血干細(xì)胞,采用“人海戰(zhàn)術(shù)”就能夠避免清髓的必要呢?
驗(yàn)證這個(gè)猜想很難,追根究底,問(wèn)題在于,造血干細(xì)胞太難養(yǎng)了。
體外培養(yǎng)造血干細(xì)胞,情況與體內(nèi)十分不同。就算用再昂貴的培養(yǎng)基,造血干細(xì)胞永遠(yuǎn)不肯乖乖自我更新,而是很快就分化成前體細(xì)胞、失去干性。科學(xué)家們幾十年里一直在研究骨髓微環(huán)境[2],試圖破解造血干細(xì)胞穩(wěn)定擴(kuò)增的奧秘,但至今還沒(méi)人能搞定這個(gè)難題[3]。
到底是哪里不行?
研究者們分析了培養(yǎng)過(guò)程中培養(yǎng)基成分的變化,發(fā)現(xiàn)大量細(xì)胞因子的出現(xiàn)促進(jìn)了干細(xì)胞的分化,而這些細(xì)胞因子的組成,看起來(lái)非常像是發(fā)生了先天性免疫反應(yīng)。研究者向培養(yǎng)基中添加了地塞米松,細(xì)胞因子便減少了。
經(jīng)過(guò)進(jìn)一步分析,研究者發(fā)現(xiàn),沒(méi)錯(cuò),培養(yǎng)基是被“污染”了,壞事兒的居然是培養(yǎng)基中的一種常見(jiàn)成分——人血清白蛋白(HSA)。
難怪以前的研究都不成功!
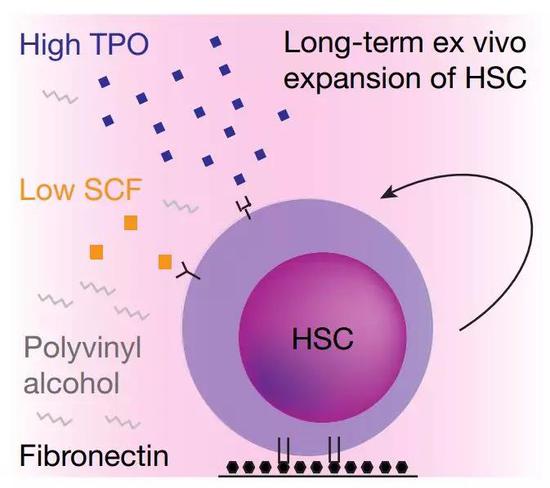
既然這樣,把HSA替換掉應(yīng)該就可以了!HSA在培養(yǎng)基中主要是起到載體的作用,研究者測(cè)試了11種高分子化合物,篩選出唯一一種能夠支持造血干細(xì)胞生長(zhǎng)和維持干性的物質(zhì),聚乙烯醇(PVA)。
值得一提的是,PVA培養(yǎng)出的造血干細(xì)胞,在移植實(shí)驗(yàn)中甚至還比HSA培養(yǎng)出的活性更強(qiáng)一些。
這個(gè)PVA是什么神物?其實(shí)PVA還蠻常見(jiàn)的,比如醫(yī)療用的水性凝膠、傷口敷料,各種化妝品的成膜劑,工業(yè)建筑材料,可降解生物膜之類。當(dāng)然,最常見(jiàn)的還是下面這個(gè)東西——膠水。

事實(shí)上,在日本媒體的采訪中,山崎副教授確實(shí)提到,用便利店買的液體膠做實(shí)驗(yàn)也成功了……
#當(dāng)然我們不建議用便利店售材料養(yǎng)細(xì)胞
##山崎老師這種話怎么可以告訴媒體辣
研究者確定了最佳的條件為100 ng/ml血小板生成因子(TPO),10 ng/ml干細(xì)胞因子(SCF),87%水解PVA,纖連蛋白培養(yǎng)。在這個(gè)條件下,50個(gè)小鼠造血干細(xì)胞28天后數(shù)量足足增長(zhǎng)了8000倍!
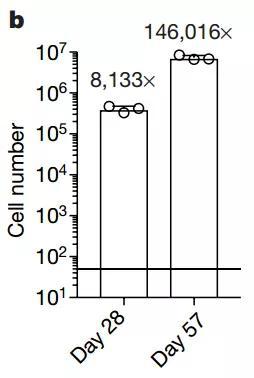
這些細(xì)胞中造血干細(xì)胞頻率大約為1:34.3,也就是差不多35個(gè)細(xì)胞中有一個(gè)是功能性造血干細(xì)胞,相當(dāng)于28天培養(yǎng)出了12000個(gè)造血干細(xì)胞。與既往研究給出的數(shù)據(jù)[4]比較,可知造血干細(xì)胞本身的擴(kuò)增大約在236倍到899倍之間。
在實(shí)驗(yàn)中,培養(yǎng)持續(xù)到57天,細(xì)胞仍可保持干細(xì)胞活性和相關(guān)表型,也未出現(xiàn)衰老征兆。
不過(guò)和前人的認(rèn)知一樣[5],造血干細(xì)胞具有明顯的功能異質(zhì)性。研究者觀察到,某些單個(gè)造血干細(xì)胞只能夠產(chǎn)生不到100個(gè)細(xì)胞,另外一些則能夠產(chǎn)生50萬(wàn)以上。
那么“人海戰(zhàn)術(shù)”能幫我們告別清髓嗎?
研究者把擴(kuò)增后的造血干細(xì)胞直接移植給小鼠,包括免疫功能正常的和缺陷的。雖然未經(jīng)清髓處理,但最后小鼠都生長(zhǎng)出了來(lái)自自體和供體兩者的血液/免疫細(xì)胞,證明移植成功了。
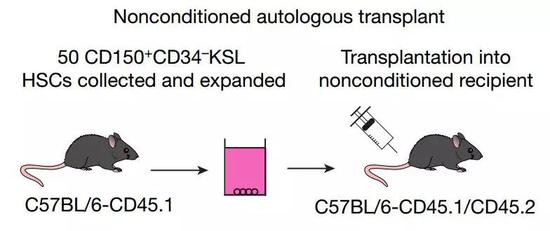
除了在骨髓抑制方面的應(yīng)用之外,中內(nèi)教授還提到,如果在培養(yǎng)過(guò)程中使用CRISPR等基因編輯技術(shù)修正遺傳缺陷,那么患者用自己的細(xì)胞來(lái)進(jìn)行基因治療也是很可行的[6]。
山崎副教授在采訪中說(shuō);“大規(guī)模培養(yǎng)能夠消除臍帶血和造血干細(xì)胞短缺的問(wèn)題,也能夠減輕骨髓抑制的負(fù)擔(dān)。”如果其他干細(xì)胞也能夠用同樣的辦法培養(yǎng),“它可能會(huì)為再生醫(yī)學(xué)和基礎(chǔ)研究做出巨大的貢獻(xiàn)。”